Гальванический элемент 9.2 является экспериментальной установкой, основанной на принципе работы химической энергии в электродных цепях. Этот элемент состоит из двух металлов или их соединений, которые взаимодействуют в химическом растворе, обладающем свойствами электролита.
В процессе работы гальванического элемента 9.2, после сборки, на катоде происходит химическая реакция, переносящая электроны на анод, где они передаются во внешнюю электрическую цепь, где их потенциал может быть использован для работы электрических устройств. Такой элемент используют во множестве областей, включая энергетический сектор, электронику и многие другие.
Классификация гальванического элемента 9.2 включает различные виды батарей, в зависимости от используемых металлов, которые являются электродами. Например, щелочные батареи всегда имеют цинковый анод и щелочной электролит, а на катоде используются металлы железа. Стоимость таких батарей доступна и они широко распространены.
Гальванический элемент 9.2 работает в определенных химических условиях, которые обеспечивают перенос электронов от анода к катоду. Элемент собирается с помощью пластикового корпуса, в котором находятся электроды и электролит, создающий необходимые реакции и потенциал. Края элемента подключаются к вольтметру для измерения напряжения.
Энергия, выделяющаяся в гальваническом элементе 9.2, может быть использована для питания различных устройств, включая аккумуляторы и литиевые батареи. Этот элемент нашел широкое применение в различных сферах, исходя из ответов на задачи и эксперименты, проводящихся в области гальваники и электрохимии. Реакции и действия между элементами данного элемента позволяют получать электрический ток.
- Принцип работы и строение гальванического элемента 9.2
- Схема работы гальванического элемента 9.2
- Применение гальванического элемента 9.2
- Применение гальванического элемента 9.2
- Примеры применения гальванического элемента 9.2:
- Качественное определение электрохимической активности металлов
- Видео:
- Продукты в ОВР. Ч.2-3. Гальванический элемент.
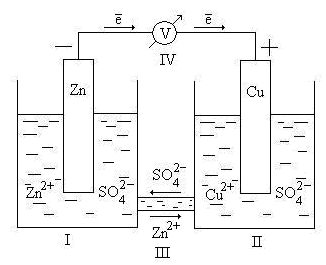
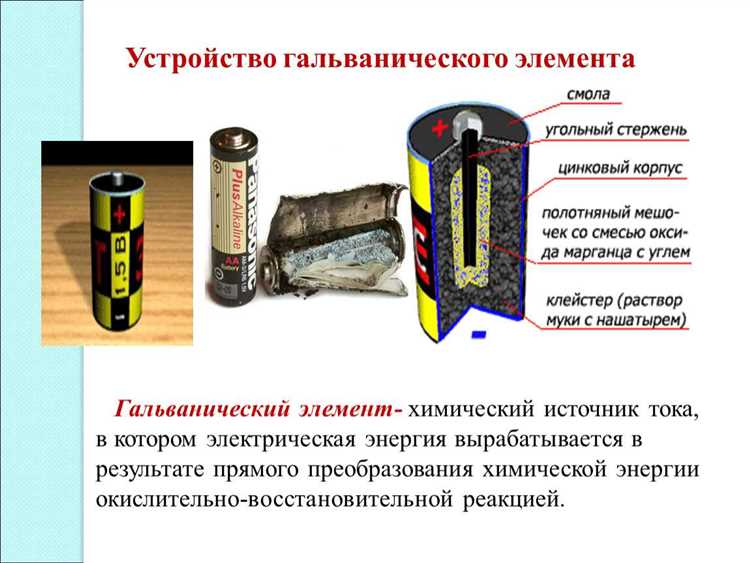
Принцип работы и строение гальванического элемента 9.2
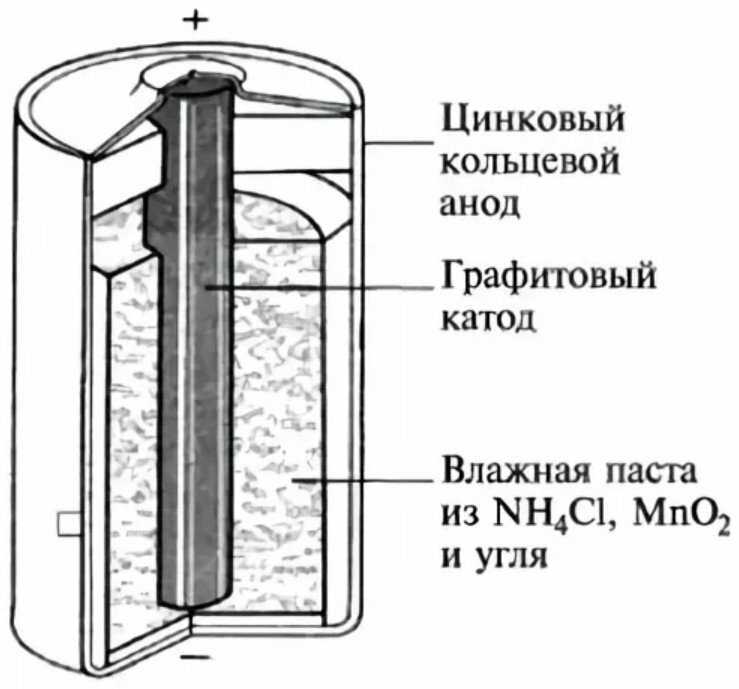
Основными элементами гальванического элемента 9.2 являются анод и катод. Анод состоит из цинка, а катод – из марганцевого диоксида. Углубление катода заполнено гелями или электролитом.
Существуют две области, где можно увидеть работу гальванического элемента 9.2: при использовании и при переработке. В обоих случаях начальное напряжение сказывается на работе приборов, работающих на электричество. А для переработки важно учитывать особенности остатков и применять свойства элементов.
В процессе работы гальванического элемента 9.2 происходят химические реакции, которые называются электролизом. Это процессы, связанные с коррозией, появлением потенциалом более активного металла на аноде и менее активного на катоде, образованием электродвижущей силы.
Одной из особенностей гальванического элемента 9.2 является наличие электролита раствора хлорида цинка. Электролит – соль, которая приобретает заряд. В схеме элемента он находится в виде геля или раствора.
Возникающая электрохимическая реакция позволяет гальваническому элементу 9.2 генерировать электрическую энергию, которая передается по цепи электрического тока к потребителю. Таким образом, гальванический элемент 9.2 является источником энергии для электрических приборов и аккумуляторов.
Строение гальванического элемента 9.2 включает в себя такие элементы, как анод и катод, электролит, схему и цепь. Кроме того, присутствуют также различные металлы, такие как цинк и марганец, которые являются частями элемента.
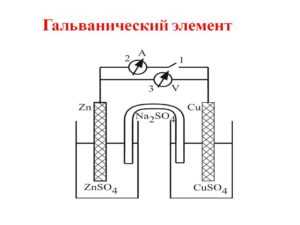
Схема работы гальванического элемента 9.2
Принцип работы гальванического элемента 9.2 заключается в преобразовании химической энергии в электрическую энергию. При этом главным элементом является электролит, который играет роль мостика между анодом и катодом.
Основные задачи гальванического элемента 9.2 включают в себя создание разности потенциалов между анодом и катодом, обеспечение электрической связи между ними, а также передачу электрической энергии через цепь к потребителю.
Применение гальванического элемента 9.2

Гальванический элемент 9.2 нашел применение в различных областях, таких как автомобильная промышленность, электроника, медицина, бытовая техника и др. Он используется в аккумуляторах, где осуществляет зарядку и обеспечивает работу устройств.
Аккумуляторы, в которых применяются гальванические элементы 9.2, позволяют накапливать электрическую энергию и использовать ее в необходимый момент времени. Это особенно важно для портативных устройств, таких как мобильные телефоны и ноутбуки.
Таким образом, гальванический элемент 9.2 является незаменимым компонентом в многих устройствах, обеспечивая их энергией и питанием.
Применение гальванического элемента 9.2
Гальванический элемент 9.2 находит широкое применение в различных областях, где требуется получение электрического напряжения. Он может быть использован как источник энергии для различных электрических приборов, таких как фонари, часы, радиоприемники, смартфоны и т.д.
Основная идея работы гальванического элемента 9.2 заключается в преобразовании химической энергии, содержащейся в электролите, в электрическую энергию. Согласно принципу гальванической ячейки, между двумя электродами аккумулятора, погруженными в электролит, происходит химическая реакция, при которой происходит перенос электронов по цепи. Этот процесс называется протеканием электрического тока.
Гальванический элемент 9.2 может быть собран из различных типов электродов и электролитов, что позволяет получить элементы с различным электрическим потенциалом. Таким образом, в зависимости от применения, можно собрать элементы с нужными характеристиками.
Примеры применения гальванического элемента 9.2:
- Изготовление гальванических батарей и аккумуляторов. Данная технология широко используется в производстве литиевых и солевых батарей, которые являются источником энергии для множества электронных устройств.
- Экспериментальная химия. Гальванический элемент 9.2 позволяет проводить эксперименты по изучению химических процессов, происходящих в электролитах и на электродах. Также он может быть использован в процессе электролиза для получения различных веществ.
- Измерение напряжения. Гальванический элемент 9.2 может быть использован в качестве источника измерительного напряжения. Подключив его к вольтметру, можно измерить разность потенциалов между электродами и таким образом получить информацию о его состоянии.
Таким образом, гальванический элемент 9.2 является важным элементом в электротехнике и химии. Его разнообразие позволяет сделать множество типов элементов, которые нашли применение в различных областях человеческой деятельности.
Качественное определение электрохимической активности металлов
Электрохимическая активность металлов определяется их способностью участвовать в реакциях окисления и восстановления. Она позволяет определить, какой металл будет переходить в раствор при проведении электролиза или в гальванической частице.
Принцип работы гальванического элемента основан на использовании разности потенциалов между двумя разными металлическими электродами, погруженными в электролитический раствор. Работа элемента основана на преобразовании химической энергии в электрическую энергию.
Строение гальванического элемента включает в себя два электрода — анод и катод, а также электролитический раствор. Анод, как правило, сделан из активного металла, который окисляется, образуя положительно заряженные ионы, которые растворяются в электролите. Катод, обычно изготовлен из инертного металла, принимает электроны и участвует в восстановительном процессе.
Принцип работы гальванического элемента основан на том, что в электрической цепи между анодом и катодом происходит падение электрического потенциала, которое приводит к протеканию электрического тока. Через электролит проходят ионы, образуя мостик между анодом и катодом.
Для качественного определения электрохимической активности металлов можно провести следующие эксперименты:
- Погрузите полоску медного металла в раствор хлорида натрия. Медь будет переходить в раствор в ионной форме, образуя положительно заряженные ионы.
- Погрузите полоску цинкового металла в раствор серной кислоты. Цинк будет окисляться, образуя ионы цинка и водород.
- Погрузите полоску своими руками набранную из щелочного раствора в серную кислоту. Полоска никак не реагирует и не изменяется. Возьмите другую полоску и поместите ее в раствор серной кислоты. Наблюдается обильное выделение пузырьков водорода.
- Используйте электрофорную ячейку для получения электричества. Погрузите медный и цинковый электроды в соответствующие растворы, подключите их к вольтметру и соедините проводами. Разность потенциалов между электродами позволит получить электрический ток.
Гальванические элементы широко используются в различных областях, включая энергетический сектор, химическую промышленность и изготовление батареек. Они являются простейшими источниками электричества, позволяющими собрать схему и получить электрический ток.
Количество электричества, вырабатываемого гальваническим элементом, зависит от разности электродвижущих сил и эффективности работы обоих электродов. Все эти параметры важны для эффективного использования гальванического элемента.
Видео:
Продукты в ОВР. Ч.2-3. Гальванический элемент.